오늘은 Sn2 반응의 속도를 결정짓는 요인들에 대해 알아보겠습니다.
반응성은
1. 이탈기
2. 기질
3. 친핵체
에 영향을 받는데요.
1. 이탈기(leaving group) (줄여서 L.G)
F- < CI- < Br- < I- < OMS - < OTS - < OTF -
(F는 반응성이 매우 작은 편)
오른쪽으로 갈수록 좋은 이탈기입니다.
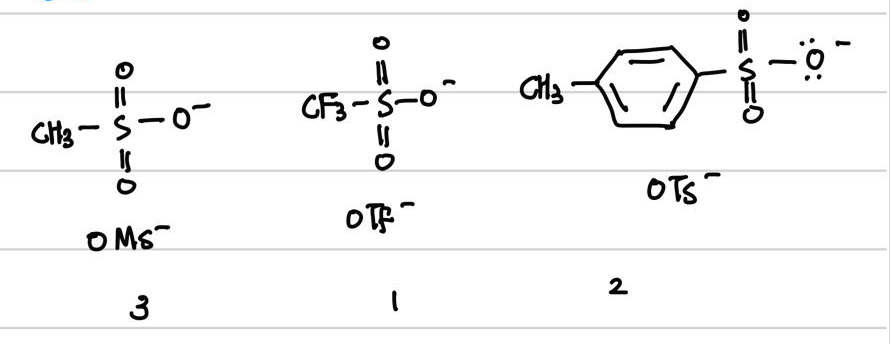
이탈되고 난 후 음이온이 안정할수록 좋은 leaving group이라고 말할 수 있습니다.
약 염기들이 좋은 L.G 입니다.
2. 기질
Sn2 반응은 back side attack을 통해 탄소를 공격하기 때문에 기질에 치환기가 많을수록 불리합니다.
치환기가 많을 수록 nu와 기질 간의 입체 무리 차이가 생겨 전이상태가 불안정해지기 때문이지요.
알파 halo carbonyl >benzyl >allyl >methyl > 1차 탄소 > 2차 탄소 > 3차 탄소
왼쪽으로 갈수록 반응성이 좋습니다.
그리고 베타 탄소의 치환기 수도 적을수록 좋습니다.
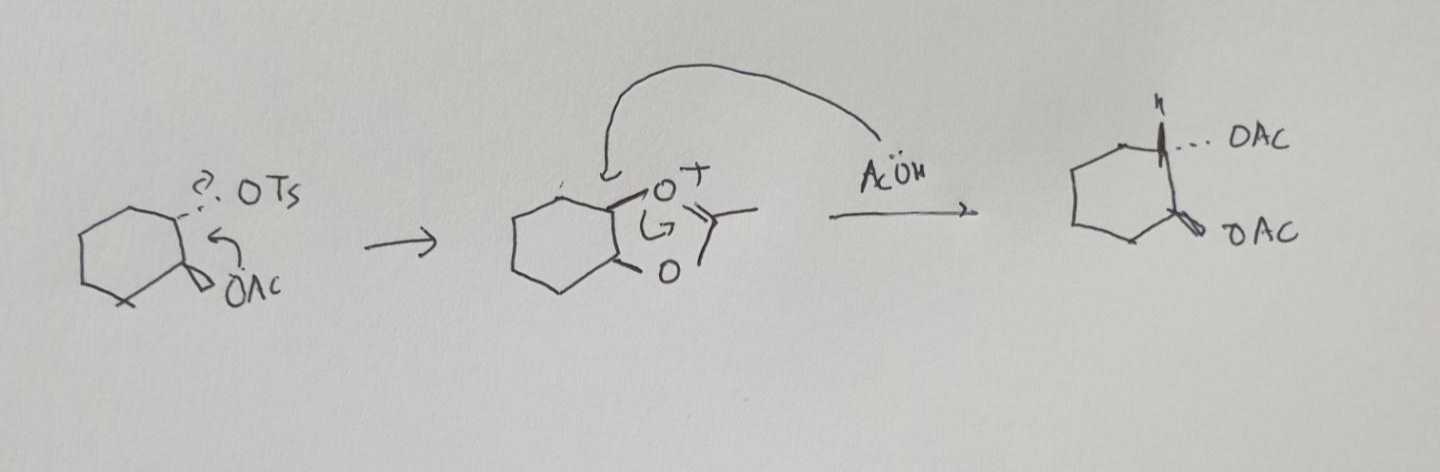
알파, 베타 탄소가 3차 탄소이면 일반적으로 Sn 2 반응이 일어나지 않습니다!
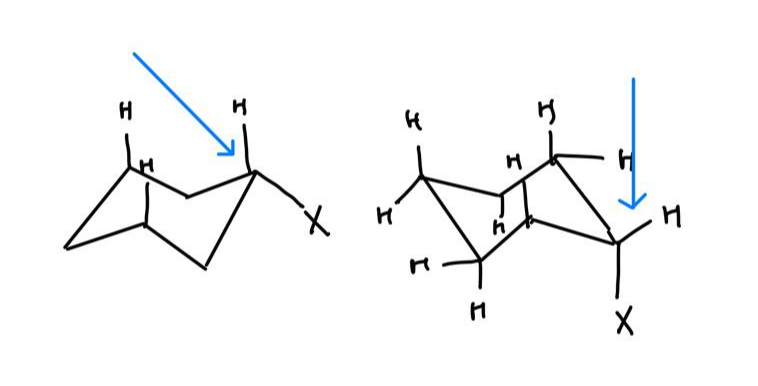
위 그림에서 왼쪽 그림보다 오른쪽 그림에서가 이분자 치환 반응이 원활하게 일어납니다.
왜냐하면 수소의 입체 무리 영향을 덜 받기 때문이지요.
기질의 입체 무리를 살펴서 그때 그 때 파악하시면 됩니다!
+ allyl halide, benzyl halide가 methyl 보다 sn2 반응성이 더 좋습니다.
왜냐하면 전이상태가 컨쥬게이션되어 안정화되기 때문입니다.
알파 halo carbonyl은 allyl, benzyl 보다 더 빠른데
컨쥬게이션 될 뿐만 아니라 산소에도 비편재화가 이루어지 때문입니다!

3. 친핵체(nucleophile)(줄여서 Nu)
친핵체는 친전자성 탄소를 공격하는 물질을 의미합니다. ( 유기화학 1 범위에서)
친핵체는 음이온과 중성, 비공유 전자쌍이 있습니다.
친핵성은 음이온이 중성보다 큽니다.
(1) 같은 주기에서 친핵성 ( 크기가 비슷, 음이온 중성 둘 다 )
같은 주기 ) 주기율표에서 왼쪽으로 갈수록 친핵성이 커집니다.
C-> N- > O - > F-
친핵체는 친전자체에게 전자를 주어 화학 결합을 만드는 역할을 하는데요.
저는 전기 음성도가 작을수록 전자를 주기 쉽기 때문에 친핵성이 크다고 이해했습니다.
(2) 같은 족 ( 중성 친핵체, 크기가 다른)
편극성의 증가는 친핵성 능력을 증가시킵니다.
(아래로 내려갈수록 = 크기가 커질수록 좋은 중성 친핵체입니다.)
핵에서 멀리 떨어진 전자쌍이 좋은 Nu가 됩니다.
N < P
O < S
(3) 같은 족 ( 크기가 다른 음이온 친핵체 )
크기가 다른 음이온 Nu의 친핵성 비교 시 반응의 용매를 고려해 주셔야 합니다!
(중성 친핵체는 용매화 효과가 작기 때문에 고려하지 않습니다.)
용매는 극성(높은 유전상수)(전하를 잘 격리시킨다 = 용매화), 무극성 용매가 있습니다.
polar solvent에는 극성 양성자성, 극성 비양성자성 용매가 존재합니다.
극성 양성자성은 OH, NH 결합을 보유하고, 극성 비양성자성 용매는 CH 결합을 보유합니다.
polar protic solvent는 수소 결합을 형성해 양이온과 음이온을 안정화시킵니다.
polar aprotic solvent는 양이온을 안정화시킵니다.
( 극. 비에서 친핵성 : F -> CI - > Br - > I -
극. 양 : F- < CI - < Br - < I -
-> 크기가 클수록 용매에 덜 안정화됩니다.)
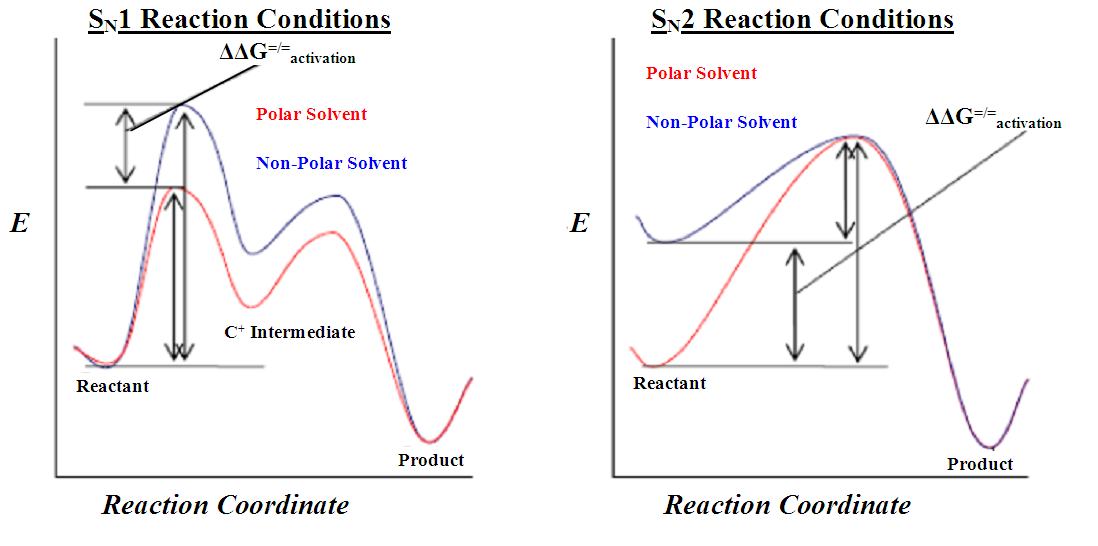 출처 : 위키피디아
출처 : 위키피디아
극. 양 용매는 음이온 친핵체를 안정화시킵니다.
오른쪽 그래프를 보면 polar solvent는 친핵체 안정화로 인해 non polar solvent 보다 넘어야 할 활성화 에너지의 크기가 큰 편이지요.
( 용매와의 상호작용이 적어야겠군요!)

따라서 SN2 반응은 극성 비양성 자성 용매를 선호합니다.
극성 비양성자성 용매는 아세톤, THF, DMF , DMSO , HMPA 등이 있습니다!
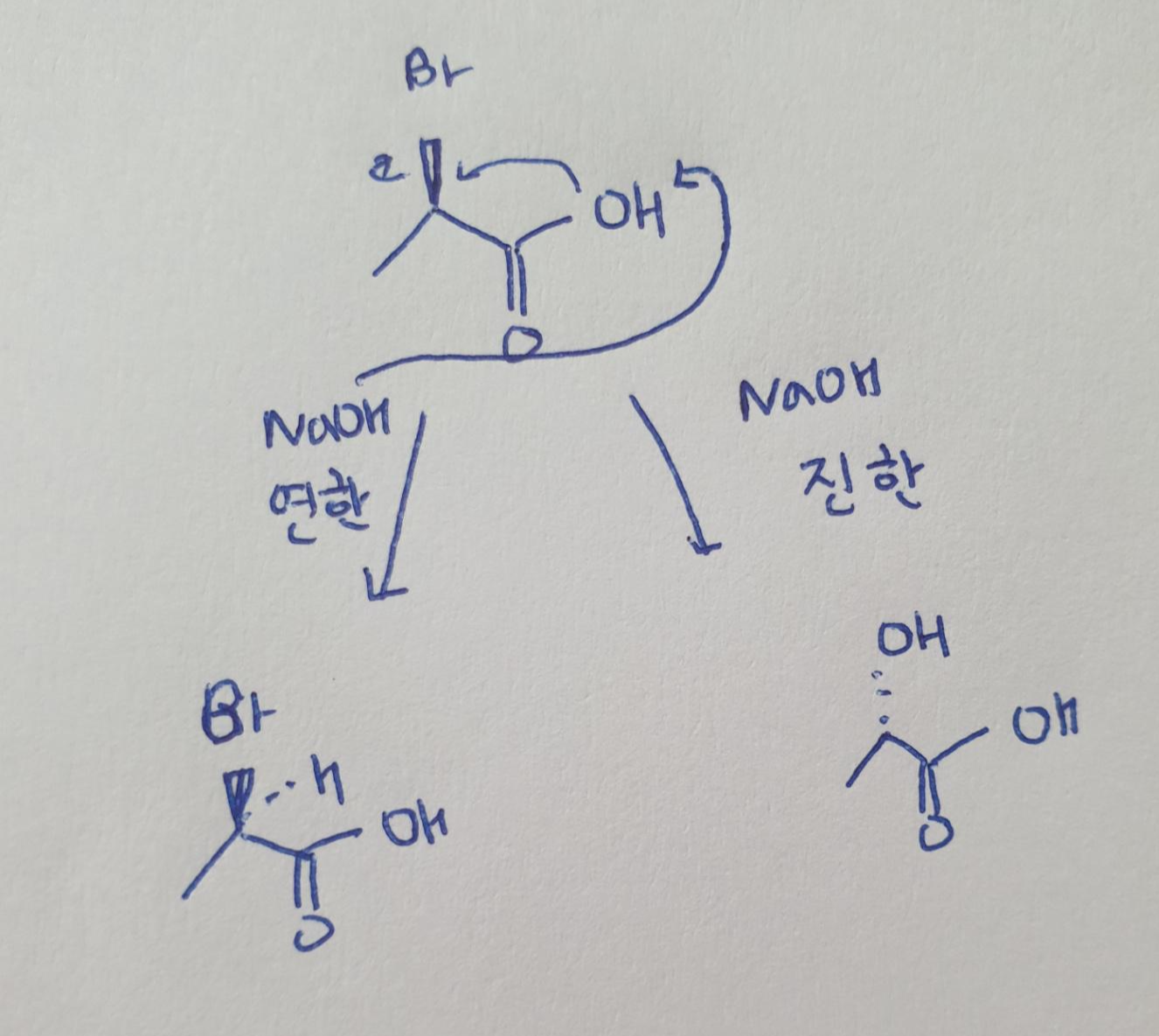
(4) 입체 장애가 있는 친핵체는 반응성이 떨어진다.
예시 : 친핵성 : -OCH3 > -O(CH3) 3
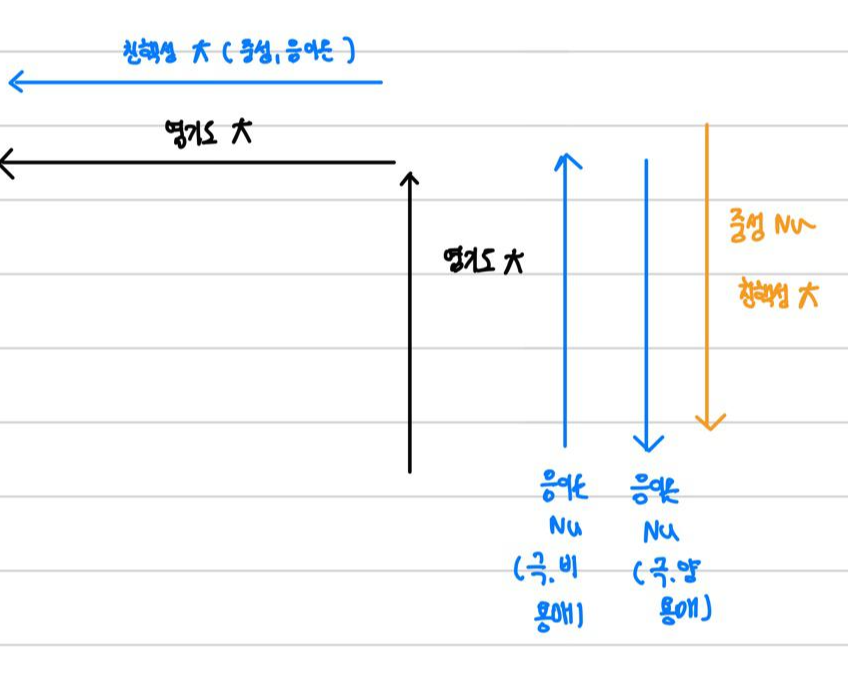 친핵성도 요약
친핵성도 요약
Q : 친핵성도는 염기성도에 항상 비례하나요?
A. 항상 그런 건 아닙니다.
지금까지 Sn2 반응의 속도를 결정짓는 요인( 이탈기, 기질, 친핵체 - 용매 )을 알아보았습니다.
특히 친핵성도가 많이 헷갈릴 텐데 꼼꼼히 공부하고 숙지하도록 합시다.